近日,陆军军医大学西南医院罗飞教授团队在细胞外囊泡研究的顶级专业期刊Journal of Extracellular Vesicles(IF=25.8)发表一篇题为“Small extracellular vesicles deliver osteolytic effectors and mediate cancer-induced osteolysis in bone metastatic niche”文章,揭示了细胞外囊泡在前列腺癌骨转移溶骨过程中发挥的关键调控作用。
本研究中的small RNA测序及分析由中科普瑞合作完成。

超90% 的转移性前列腺癌患者会发生骨转移并导致病理性骨破坏。骨转移微环境中,肿瘤细胞与骨细胞相互作用导致骨重塑失衡的分子机制已成为近年来的研究重点。在骨转移生态位中,肿瘤细胞与破骨细胞和成骨细胞相互作用,导致以恶性循环为特征的异常骨重塑。肿瘤微环境中,癌细胞可释放大量小细胞外囊泡 (sEVs),并影响周围的细胞。最近,癌症衍生的 sEV 已被证明参与了肿瘤相关的血管生成、血管通透性和和免疫反应等生物学过程。该课题组研究发现,前列腺癌细胞PC3通过囊泡水平的miRNA递送,调控破骨细胞形成以及肿瘤引起的溶骨性破坏。
部分结果展示
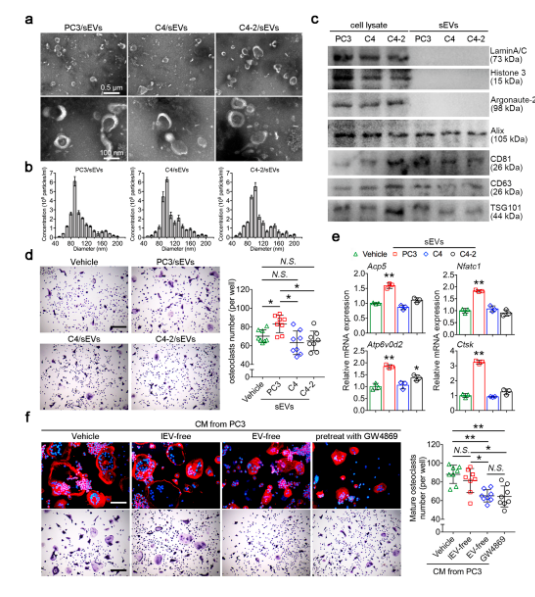
???? PC3衍生的sEVs促进破骨细胞的形成
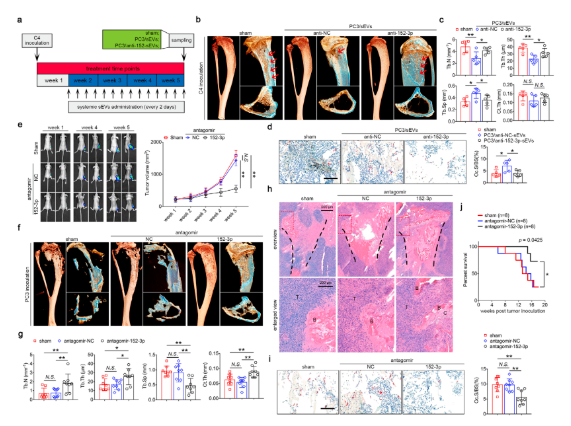
三种人前列腺癌细胞系:PC3、C4和C4- 2中分离鉴定sEV。从小鼠后肢中分离骨髓巨噬细胞( BMMs)与sEV共同培养后进行 TRAP 染色,发现PC3/sEVs 可诱导破骨细胞的生成,表明 sEVs 可能参与骨肿瘤微环境中肿瘤细胞和破骨细胞之间的细胞间通讯。
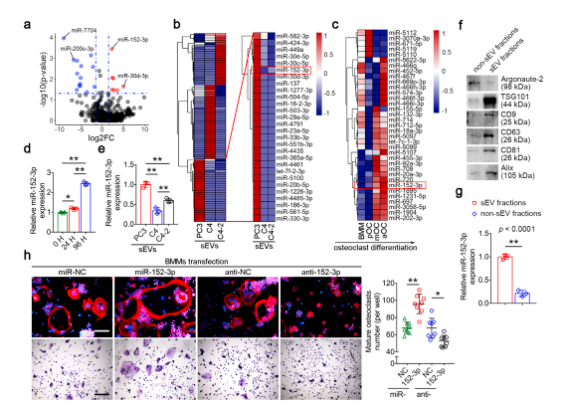
????sEVs中的miR-152-3p 参与破骨细胞生成
从溶骨细胞系PC3和非溶骨细胞系C4和C4-2中鉴定 sEV 中特异表达的 miRNA 特征。进一步的生物信息学分析和体外实验表明,miR-152-3p 在溶骨性 PC3 细胞及其同源 sEV 中富集,并且可以转移到受体BMM。在 BMM 向破骨细胞分化过程中 miR-152-3p 的持续上调,表明其可能参与调节破骨细胞分化,定量实验进一步验证了此结论。
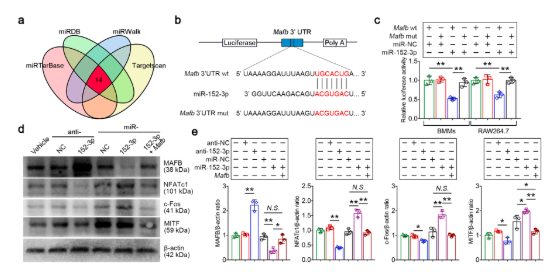
???? Mafb是miR-152-3p的靶向调控基因
使用了四种mRNA靶点预测算法预测miR-152-3p的潜在下游靶点,并通过荧光素酶报告及western blot及细胞功能实验进行验证。结果表明miR-152-3p通过抑制Mafb的表达来促进破骨细胞的形成。
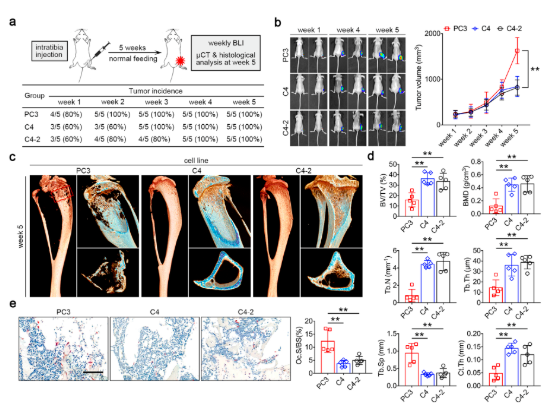
???? PC3增加肿瘤负担,诱发骨溶解的发生
肿瘤细胞注入BALB/c裸鼠胫骨髓腔建立原位异种移植小鼠模型,观察发现,与非溶骨C4和C4-2细胞系相比,PC3诱导了典型的溶骨表型和更为严重的肿瘤负荷。
???? 靶向miR-152-3p干预肿瘤生长过程中的溶骨进展
小鼠模型给药实验表明,miR-152-3p拮抗剂治疗可维持皮质骨、软骨下骨、生长板和胫骨骨骺的结构完整性,且使肿瘤诱导的破骨细胞数量显著减少,小鼠生存率增加。
小 结
该研究系统阐述了细胞外囊泡在破骨细胞分化和肿瘤溶骨进程中的关键作用,发现肿瘤以通过EV传递生物活性分子,进而加快肿瘤溶骨恶性循环的进程,为进一步揭示骨转移生态位中细胞间相互作用,特别是肿瘤细胞和破骨细胞间的串扰机制奠定了基础。同时,该研究提示,靶向骨吸收和调控microRNA表达等药物的应用,可以通过阻断破骨细胞的形成和功能,为干预和治疗肿瘤溶骨性病变提供了新策略,为骨质疏松等多种骨骼疾病的诊疗和新型骨修复材料的研发提供新思路。


