近日,重庆医科大学陈娟/黄爱龙/郑璐教授共同通讯在国际肝脏病学领域顶级期刊Hepatology(IF=17.43)在线发表题为 “DDX17-regulated alternative splicing that produced a novel oncogenic isoform of PXN-AS1 to promote HCC metastasis” 的研究成果,该研究发现DDX17通过调节PXN-AS1的选择性剪接促进肝癌转移,表明DDX17有可能成为肝癌治疗的靶点。
本研究转录组测序及相关分析由中科普瑞合作完成。
肝细胞癌(HCC)是癌症相关死亡的第二大原因。由于高转移率和术后复发率,HCC 的不良预后仍然是一个挑战。因此,迫切需要深入了解 HCC的进展和转移机制。可变剪接事件(AS)是扩展基因表达模式和产生蛋白质多样性的关键生物过程。异常 AS 事件被认为是癌症进展的关键标志之一。研究发现,DDX17可通过多种机制影响癌症的发生和进展,并参与许多重要的肿瘤相关基因可变剪切剪接。然而,DDX17在选择性剪接和 HCC 中的作用尚未得到很好的研究。该研究进鉴定了lncRNA-PXN-AS1被 DDX17 调节的 AS 事件,该事件参与促进 HCC 的转移,意味着 DDX17 具有作为 HCC 治疗靶点的潜力。
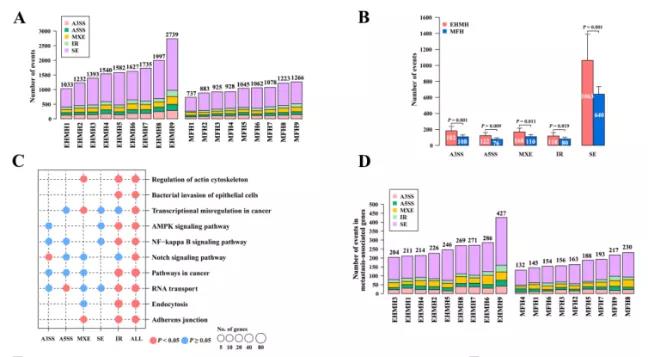
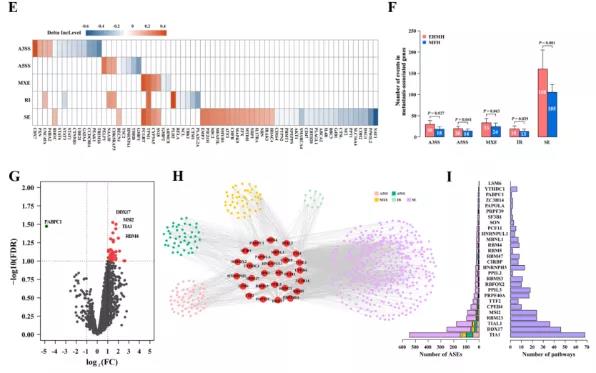
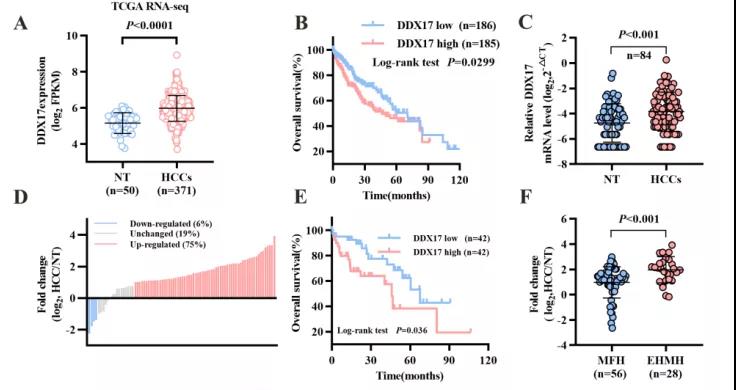
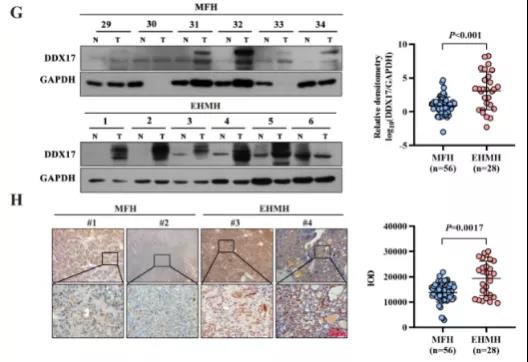
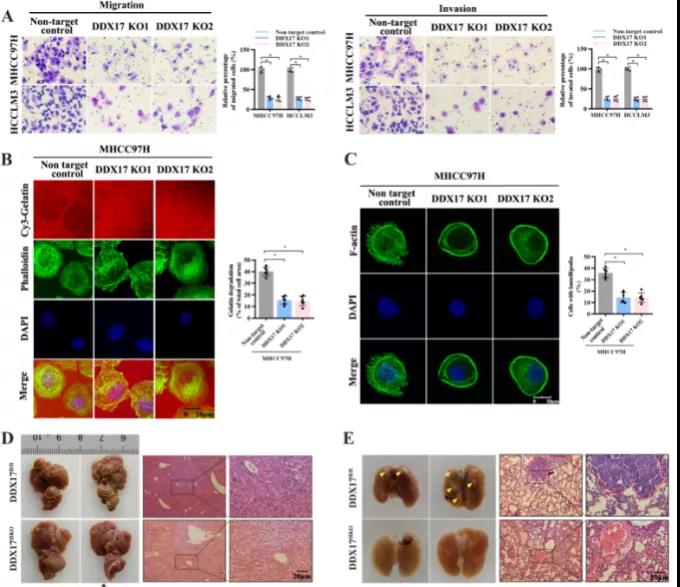
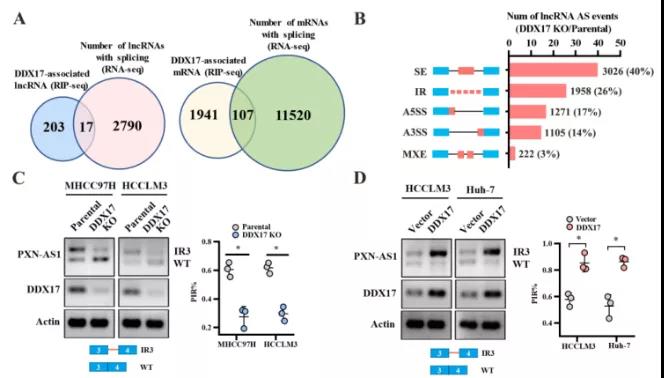
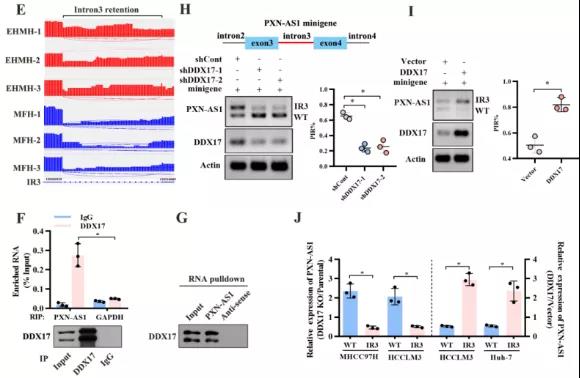
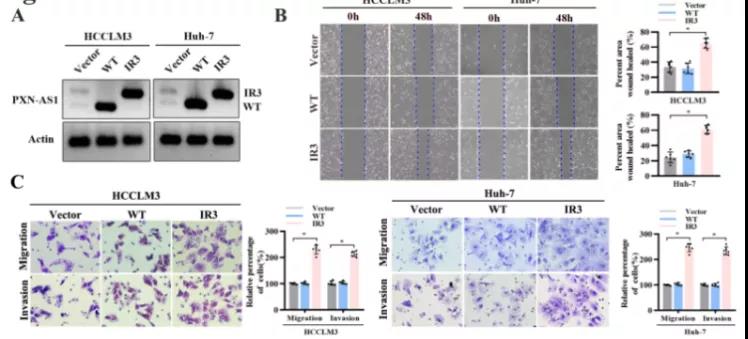
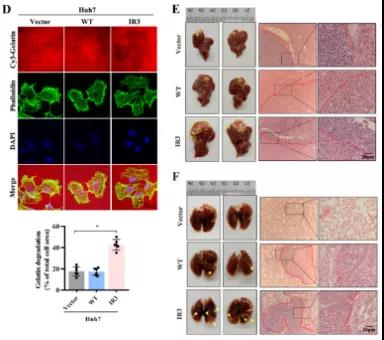
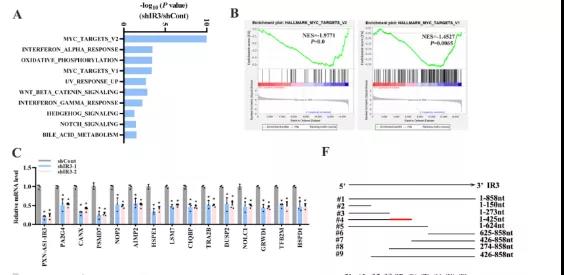
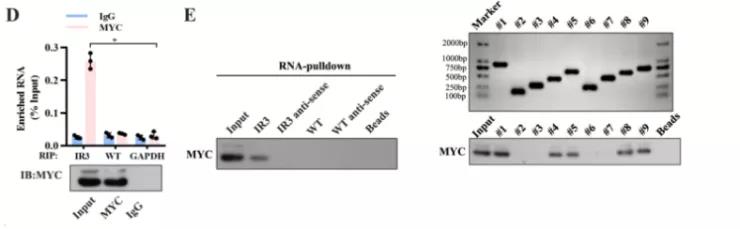
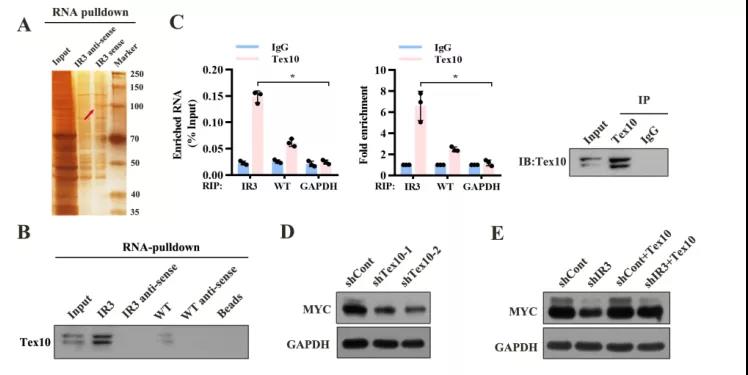
主要研究结果展示 DDX17表达与肝癌转移密切相关 对9对伴远处转移的原发性HCC和9对无转移的原发性HCC的癌组织进行RNAseq,数据分析发现28个剪接因子及相关的异常可变剪接事件与肝癌转移显著相关,其中RNA解旋酶DDX17是重要的剪接调控因子。 HCC患者DDX17表达上调与临床生存密切相关 TCGA-LIHC数据和临床标本分析发现DDX17表达上调与HCC病人的不良预后密切相关。 DDX17敲除可抑制体内外HCC转移 细胞功能实验及小鼠模型实验发现,DDX17的敲除可抑制体内及体外HCC的侵袭和转移。 DDX17诱导lncRNA-PXN-AS1内含子在HCC细胞中的保留 机制研究发现在HCC细胞系和HCC组织中高表达的DDX17可诱导lncRNA-PXN-AS1第三个内含子发生内含子保留,产生新的异常剪接异构体PXN-AS1-IR3。 PXN-AS1-IR3促进肝癌细胞在体内外迁移和侵袭 细胞实验及小鼠模型实验发现PXN-AS1-IR3过表达可抑制体内及体外HCC的侵袭和转移。 PXN-AS1-IR3可增强HCC中的MYC信号 RNA-seq筛选PXN-AS1-IR3调控的下游基因, GSEA对差异表达基因进行分析发现PXN-AS1-IR3调控基因参与MYC信号信号通路。RIP及RNA pull down证实MYC蛋白与PXN-AS1-IR3的特异性关联。细胞实验发现PXN-AS1-IR3可增强HCC中的MYC信号。 PXN-AS1-IR3与Tex10特异性结合 RNA pull down实验检测PXN-AS1-IR3特异性关联的蛋白,研究发现,PXN-AS1-IR3可招募Tex10和p300复合物到MYC增强子区,激活MYC及其下游转移相关基因转录。 小结 高表达的DDX17可诱导lncRNA-PXN-AS1发生内含子保留,产生新的异常剪接异构体PXN-AS1-IR3。PXN-AS1-IR3进一步招募Tex10和p300复合物到MYC增强子区,激活MYC及其下游转移相关基因转录,最终促进HCC肿瘤转移。 HCC中DDX17、PXN-AS1-IR3与MYC表达的相关性模式图